多发性骨髓瘤药物成企业竞逐新热点

据悉,2016年4月24日,国家药品审评中心公示拟将双鹭药业的来那度胺原料药和胶囊制剂纳入优先审评程序抗肿瘤药物注册申请。如果进展顺利,国产来那度胺上市指日可待,将给中国抗肿瘤药物市场注入新鲜血液。
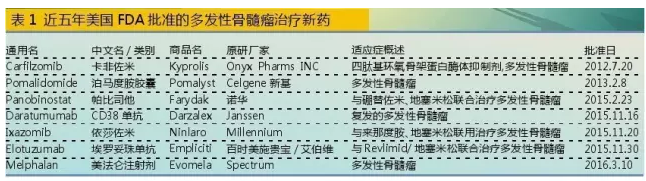
2012年至2016年3月,美国FDA批准了7个多发性骨髓瘤治疗药物。仅2015年FDA批准的新药中,就有4个多发性骨髓瘤治疗药物,占据当年抗恶性肿瘤上市药物的28.57%。多发性骨髓瘤治疗药物已经成为制药企业竞逐的新热点,也给相关患病群体带来福音。
1多发性骨髓瘤引关注
2013年10月,国际骨髓瘤工作组(IMWG)发布了全球治疗骨髓瘤共识。同年,《中国多发性骨髓瘤诊治指南》进行了第3次修订,相比2011版具有更高的可操作性,从而推动了我国多发性骨髓瘤规范性诊治。
多发性骨髓瘤是一类发生于B淋巴细胞的恶性浆细胞病。通常骨髓瘤细胞在骨髓内及骨骼海绵软组织内克隆性增生,引起溶骨性骨骼破坏,愈后不良多伴有贫血、肾衰竭和骨髓瘤细胞髓外浸润所导致的多种损害。国际公认数据显示:多发性骨髓瘤美国发病率男性为7.1/10万,女性为4.6/10万;多数发达国家MM的发病率为4/10万,中国为1/10万。
另据《国际骨髓瘤基金会》发布的最新数据显示,全球多发性骨髓瘤患病人数达75万人左右,全球每年新发病例约为11.40万人,属于罕见性恶性肿瘤之一。迄今,多发性骨髓瘤病因与发病机制尚不清楚,可能与电离辐射、慢性抗原刺激、EB病毒或卡氏肉瘤相关的疱疹病毒感染诱发癌基因高表达有关。
中国多发性骨髓瘤的发病率已经超过急性白血病,是仅次于非霍奇金淋巴瘤之后居于第二位的血液系统恶性肿瘤,是人过中年之后为数不多的群体面临的又一“多事之秋”。值得一提的是,在多种因素影响下,近年多发性骨髓瘤已有发病比率上升、发病年龄提前的趋势。因此,MM治疗新药让许多制药公司趋之若鹜。
目前,国际通用治疗方法包括化疗、移植及放疗。我国目前治疗骨髓瘤的方法主要是干细胞移植、硼替佐米联合方案以及传统的联合用药方案。随着多发性骨髓瘤治疗新药的不断涌现,使其疗效得到了提高、改善了预后,客观上也带动了多发性骨髓瘤治疗市场的增长。
22015年MM新药研发管线开闸
对于多发性骨髓瘤新药上市而言,2015年无疑是个丰收大年。2015年新上市的MM药物分别是:Farydak(帕比司他)、Darzalex(CD38单抗)、Ninlaro(依莎佐米)和Empliciti(埃罗妥珠单抗)。新药上市不但给MM患者用药提供了多种差异性选择机会,同时也推进了全球MM市场的快速发展。
⒈“帕比司他”开门红
2015年2月23日,新年伊始,美国FDA首先批准了诺华公司的HDAC抑制剂帕比司他(Panobinostat),商品名Farydak。帕比司他和硼替佐米、地塞米松联合使用,主要针对性治疗此前接受过硼替佐米和一种免疫调节剂后的复发多发性骨髓瘤。
FDA授予帕比司他优先审评及孤儿药资格。帕比司他通过抑制组蛋白去乙酰化酶(HDACs)的活性而发挥作用,这一过程可能延缓了多发性骨髓瘤患者体内浆细胞的过度发生,或导致这些危险细胞死亡。
帕比司他是首个获得FDA认可的治疗多发性骨髓瘤的HDAC抑制剂药物,与以往获批的多发性骨髓瘤治疗药物作用机制不同,使其成为极具吸引力的新药。
2岁尾好戏连台
接近2015年末,美国FDA于2015年11月16日通过优先审评途径批准了强生旗下杨森公司的单克隆抗体药物Daratumumab上市,商品名Darzalex。临床用于接受过蛋白酶抑制剂和免疫抑制剂治疗后复发的多发性骨髓瘤。这是一个CD38单克隆抗体,靶向结合多发性骨髓瘤细胞表面高度表达的跨膜胞外酶CD38分子,可通过多种机制诱导肿瘤细胞的快速死亡。但是,在治疗前需要对药物毒性和治疗作用性价比进行充分评估,方能有的放矢地进行治疗。
随后于2015年11月20日,美国FDA批准了日本武田旗下千年公司开发的新药依莎佐米(Ixazomib)胶囊上市,商品名Ninlaro。依莎佐米是一种口服蛋白酶体抑制剂,通过抑制多发性骨髓瘤细胞的酶活性从而阻止癌细胞的生长和存活来发挥作用。依莎佐米与来那度胺和地塞米松联用治疗接受过治疗的多发性骨髓瘤患者。
2015年底好戏联袂,美国FDA于11月30日又批准了百时美施贵宝与艾伯维联合开发的新药埃罗妥珠单抗(Elotuzumab)上市,商品名Empliciti。埃罗妥珠单抗将与来那度胺和地塞米松联合用于已接受一种或多种治疗方案的复发/难治性多发性骨髓瘤患者的治疗。埃罗妥珠单抗已获得FDA突破性疗法认定、优先审批以及孤儿药资格的待遇。
3全球市场五霸鼎立
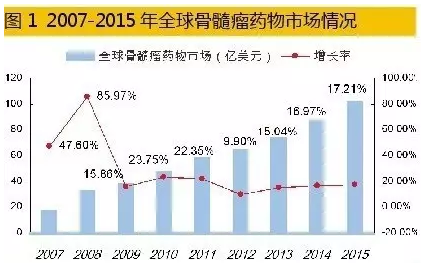
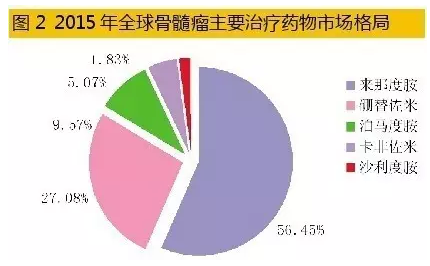
统计数据表明,2015年全球七大药品市场多发性骨髓瘤治疗药物销售额已达102.76亿美元,同比上一年增长率为17.21%,2011-2015年年平均增长率为16.29%,已经形成了硼替佐米、卡非佐米、来那度胺、泊马度胺和沙利度胺等五大品种竞争的市场格局。其中,来那度胺占据56.45%,硼替佐米占据27.08%,其余3个药物占据16.47%。据彭博社Sam Fazeli预测,2020年全球骨髓瘤药物销售总额有望达到202亿美元。
4国内市场星光熠熠
2015年12月,中国医师协会血液科医师分会、中华医学会血液学分会、中国医师协会多发性骨髓瘤专业委员会联合修订了《中国多发性骨髓瘤诊治指南2015》。该指南对有症状骨髓瘤的初始治疗有多种方案,主要药物有:硼替佐米、来那度胺、沙利度胺、阿霉素、环磷酰胺、长春新碱、卡莫司汀、依托泊苷、美法轮和地塞米松多种组方的鸡尾酒疗法。
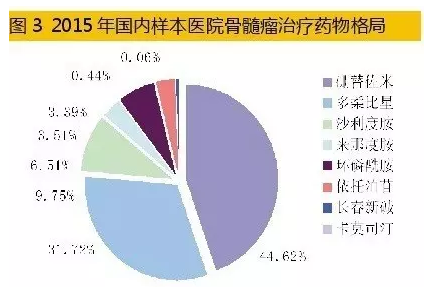
国内多发性骨髓瘤治疗市场是一个快速增长的领域。据HDM系统数据,2015年,国内重点城市样本医院多发性骨髓瘤药物用药金额为3.93亿元,同比上一年增长23.72%。蛋白酶体抑制剂硼替佐米、免疫调节剂来那度胺和沙利度胺是临床上化疗组合方案的基础药物,组成复方二联、三联、四联给药治疗。2015年国内重点城市样本医院MM用药结构中,硼替佐米占据44.62%、抗肿瘤抗生素药物多柔比星占据31.72%、来那度胺仅占据3.39%;其它抗肿瘤化药占据了20.27%。
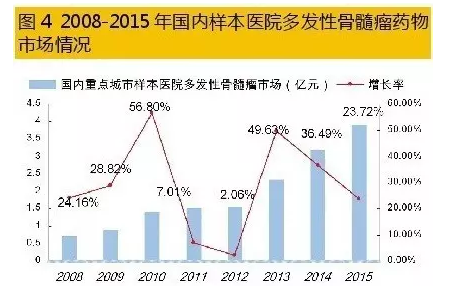
5硼替佐米仿制市场不同凡响
硼替佐米属于蛋白酶体抑制剂类药物,2003年5月由日本千年制药公司研制开发上市,美国FDA批准硼替佐米用于治疗复发、难治性多发性骨髓瘤,商品名为Velcade(万珂)。它的泛素-蛋白酶体通路作用机制荣获2004年诺贝尔化学奖,2006年该药又荣获制药业最高殊荣——国际Prix Galien大奖。万珂是日本武田公司旗下的骨干品种,美国以外市场由强生公司合作拓展;现已在全球近百个国家和地区临床使用。
数据表明,2015年全球硼替佐米销售额为27.83亿美元,同比上一年增长了10.17%;随着免疫调节剂来那度胺和沙利度胺的竞争,以及万珂专利期的临近,市场增长率处于缓慢态势。
硼替佐米是全球第一个以蛋白质酶体为靶向治疗的癌症药物。蛋白酶体是具有多催化活性位点的蛋白酶复合体,可降解绝大多数蛋白质达到诱导细胞凋亡的结果,同时对恶性骨髓瘤病人化放疗显示了增敏作用机制。硼替佐米在中国、美国、欧洲化合物专利到期时间均为2015年10月27日,但美国已延长至2017年5月3日,欧洲也延长至2019年4月25日。随着硼替佐米原研药专利保护在不同区域的终结,仿制药抢仿进入倒计时。
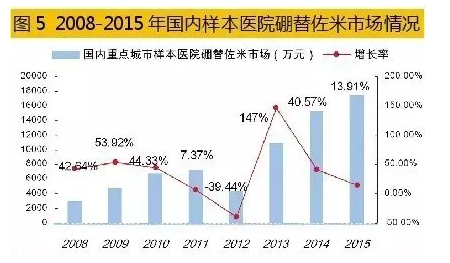
据米内网数据,2015年国内重点城市样本医院硼替佐米用药金额为1.75亿元,同比上一年增长了13.91%,由强生旗下的杨森公司独家经营。据了解,国内已有研制开发硼替佐米的企业。由于硼替佐米合成工艺和反应条件难度较大,其小试生产工艺还在进一步优化,而中试放大和临床试验仍在进行中。
6国产来那度胺上市在即
来那度胺是由美国Celgene生物制药公司开发的抗肿瘤药物,2005年底获FDA批准上市,商品名Revlimid(瑞复美),临床用于多发性骨髓瘤和骨髓增生异常综合症,现已是全球治疗多发性骨髓瘤的“金标准”药物。
来那度胺专门针对复发难治性多发性恶性骨髓瘤,已超越硼替佐米等一线治疗药物。来那度胺是沙利度胺的类似物,两者只有一个元素的差别而被称为结构衍生物,二者虽具有相似的特性,但在临床疗效上有较大差异,从而带动了来那度胺市场的快速增长。
2005年,Celgene的来那度胺上市当年,销售业绩仅为0.03亿美元。10年后, 2015年全球来那度胺销售额已达58.01亿美元,相比上一年同期增长16.49%。2016年一季度,来那度胺销售额为15.74亿美元,同比增长17%,成为与瑞士诺华治疗慢性粒细胞白血病药物格列卫同日而语的品种。
2013年1月,CFDA批准英国Celgene Europe Limited公司的来那度胺胶囊在中国的注册,商品名为瑞复美(Revlimid)。同年6月,瑞复美正式在中国上市,与地塞米松联合治疗多发性骨髓瘤。临床研究证实,瑞复美在多发性骨髓瘤患者治疗中展示了高有效性和高安全性,可有效延长中国多发性骨髓瘤患者的生存期,并提高患者的生活质量。
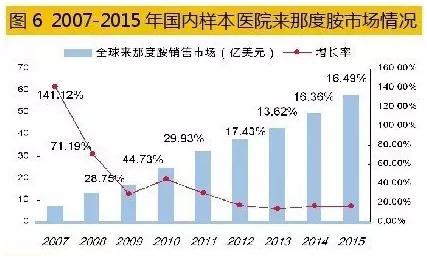
据米内网数据,2014年国内重点城市样本医院来那度胺胶囊用药金额为1051万元,同比上年增长了13.4倍;2015年这一数据为1333万元,同比上年增长了26.83%,处于平稳增长趋势。
在中国专利数据库中,检索到来那度胺原研药物化合物专利(ZL97180299.8)将于2017年7月到期,但是部分核心专利的有效期2024年才到期。
北京双鹭药业子公司——南京卡文迪许生物工程技术有限公司完成临床试验申报的来那度胺采用了全新路线,该发明已于2009年被国家知识产权局成功受理。同时,该公司还发明了来那度胺的3种新的多晶型物Ⅰ、Ⅱ、Ⅲ,也于2009年10月被国家知识产权局成功受理。为了加强知识产权保护,目前来那度胺已在美国、欧洲、韩国、日本、澳大利亚、印度等国申请了专利,部分专利已获得专利授权。通过CFDA官网获知,国内已有11家公司研制开发该药,并已获得临床试验批文。

据悉,2012年6月,北京双鹭药业首仿的来那度胺获得CFDA的3.1类新药Ⅰ期临床试验批件。临床试验结果已展现出其确是一个众望所归的药物,其双重作用机制和口服制剂的优势,提高了患者的依从性,将以较高的性价比改善MM群体的生存。2014年11月18日在国内第一家申报生产。2016年4月24日,国家药品审评中心公示拟将双鹭药业的来那度胺原料药和胶囊制剂纳入优先审评程序抗肿瘤药物注册申请。如果进展顺利,国产来那度胺上市指日可待。
文章来源:医药经济报

